
导语:目前,新冠肺炎疫情(以下简称“疫情”)在美国全境大规模蔓延,我们不能因特朗普政府疫情应对不力,就断定美国国家生物防御体系脆弱不堪。本文通过分析美国国家生物防御体系的顶层设计、特点以及物资储备的“生物盾计划”,为我国构建和完善国家生物防御体系、应对突发重大公共卫生事件、防范化解生物安全风险提供有益借镜。

美国将生物安全视为国家安全的重要组成部分,通过一系列的顶层设计和跨部门协作,构建了相对完备的国家生物防御体系。2018年9月18日,美国特朗普政府发布《国家生物防御战略》,并同时发布《国家安全总统备忘录14》(NSPM-14)作为该战略的实施计划。该战略是迄今为止美国应对各类生物安全威胁最全面的系统性战略性文件,其发布标志着美国生物防御体系建设水平达到了新的高度。《国家生物防御战略》将蓄意的、自然发生的和意外暴发的生物威胁并重,并突出传染病和生物武器的威胁。《国家生物防御战略》提出美国国家生物防御战略的五大目标:第一,强化生物防御风险意识,促进生物防御决策;第二,确保生物防御单位有能力防范生物事件;第三,做好生物防御准备工作;第四,建立迅速响应机制以降低生物事故的影响;第五,促进生物事件后的社会、经济和环境的恢复工作。
此后,美国又于2018年10月和2019年1月陆续发布《美国卫生安全国家行动计划》与《国家卫生安全战略实施计划2019-2022》,继续构建并完善美国跨部门跨机构的防控机制,以举国之力构建生物防御体系。《美国卫生安全国家行动计划》部署了数百项跨政府部门和相关机构的活动,强调跨学科、跨部门与国际社会合作,并提出通过强化与州和地方政府以及私营部门的合作加强地方一级生物防御能力。该行动计划为美国《国家生物防御战略》提供了一个意义重大的监测和评估机制,帮助跟踪相关活动,并为战略实施提供信息支撑。行动计划涉及19个专业领域的行动项目,并在以下10个领域采取优先措施:抗菌药物耐药性、人畜共患传染病、食品安全、生物安全和生物安保、实时监测、应急准备、应急响应处理、风险沟通、化学事件和紧急放射事件。《国家卫生安全战略实施计划2019-2022》用以指导美国政府和合作伙伴开发更灵活的突发公共卫生事件应对程序,来处理当前和未来可能出现的化学、生物、放射性和核威胁(CBRN)。该计划确立了三大战略目标:一是组织协调政府各部门力量,应对突发公共卫生事件和灾害;二是保护国家免受新发、流行性传染病和CBRN的影响;三是调动私营部门应对大规模传染病疫情和突发公共卫生事件的快速部署能力。
美国政府依据《国家生物防御战略》成立了一个内阁级、跨部门的生物防御指导委员会,由卫生和公众服务部(HHS)部长担任主席,由国务卿、国防部长、司法部长、农业部长、退伍军人事务部长、国土安全部长和环境保护局长负责监督、协调战略及执行,并确保与国内和国际政府及非政府合作伙伴进行协调。《美国卫生安全国家行动计划》与《国家卫生安全战略实施计划2019-2022》补充并完善了相关跨部门协作的机制。在生物危机发生时,美国国防部、联邦调查局、卫生与公众服务部、联邦紧急措施署、环境保护局和能源部将共同建立危机应对体系。对于重大生物突发事件,联邦紧急措施署将成为总协调部门,所有信息将汇入该机构。
根据世界卫生组织(WHO)推荐的标准,生物安全四级(BSL-4)实验室是全球生物安全最高级别的实验室。BSL-4实验室的结构和设施、安全操作规程、安全设备专门用于对人体具有高度危险性,通过气溶胶途径传播或传播途径不明,目前尚无有效的疫苗或治疗方法的致病微生物及其毒素的研究。BSL-4实验室是生物防御体系建构中不可或缺的重要组成部分,BSL-4实验室支撑起国家生物防御的科研基础。美国国家生物防御科研力量强大,其拥有世界上最多的BSL-4实验室。根据世界卫生组织2018年相关数据,目前在美国境内有12个正在运作或在建的BSL-4实验室设施。[1]

2001年“9·11”及“炭疽邮件”事件之后,美国联邦政府和国会都认定需要新的医疗应对措施(medical countermeasures,如诊断测试、药物、疫苗和其他治疗)以应对CBRN毒剂袭击。但由于CBRN毒剂引起的疾病和病症很少发生,制药行业认为对其投入数亿美元研发缺乏商业市场,经济动力不足。2004年,美国国会通过了《生物盾计划法》(Project BioShield Act),向联邦政府授予针对CBRN毒剂医疗应对措施的开发、采购和使用有关的新权力,通过政府投入资金研发和大量采购储备,解除制药商的经济顾虑,从而促进扩充和更新美国国家生物防御医疗应对措施的“国家战略储备”。
“生物盾计划”的目标是通过研究、开发、采购和储备针对可能用于生物攻击的炭疽热、天花、肉毒毒素、放射性和核以及神经毒剂等威胁的新一代疫苗、药物、诊断和治疗等医疗应对措施,从而实现国家在遭受生物攻击或威胁时可以快速高效地应对,保护美国人民健康,保障国家安全,并为相关措施的商业化提供了政府担保。
(1)计划资金
2003年10月1日,小布什总统签署《2004财年国土安全部拨款法》及其补充条款,为“生物盾计划”2004至2013财年拨款55.93亿美元。2013年《流行病和所有危险准备再授权法》(下文简称《再授权法》)授权为“生物盾计划”2014至2018财年拨款28亿美元。《2014财年综合拨款法案》为“生物盾计划”的维持采购提供2.55亿美元。2019年《大流行与全方位灾害准备法》(下文简称《准备法》)授权为“生物盾计划”2019至2028财年拨款71亿美元。
在为“生物盾计划”拨款的同时,国会保留了通过取消、转移或追加拨款来减少或增加该计划特别储备基金数额的权力。2004至2013财年,国会取消或转移了22.91亿美元的预拨款用于其他目的,约占原预拨款55.93亿美元的40%。[2]2013年《再授权法》允许卫生和公众服务部长将不超过14亿美元的“生物盾计划”2014至2018财年拨款转至生物医学高级研究和开发局,用于高级开发。但卫生和公众服务部长必须将此类转移通知国会,并每年报告“生物盾计划”采购剩余的资金数额。国会可以通过未来的拨款法条款限制或扩大此类转移。
(2)未获批产品的紧急使用
美国食品药品监督管理局对医疗应对措施设计了标准的批准和许可程序,保护人们免受无效或危险的治疗。《生物盾计划法》允许卫生和公众服务部长可在军事、国内或公共卫生紧急情况期间、重大潜在紧急情况期间或在识别出足以影响国家安全的重大威胁之后,暂时使用未经食品药品监督管理局批准的医疗应对措施(包含未经“生物盾计划”获得的产品)。此类许可被称为“紧急使用授权”。《再授权法》修改了卫生和公众服务部有关医疗应对措施紧急使用的权限。根据《再授权法》,在确定存在重大公共卫生紧急情况的潜在可能性之后,卫生和公众服务部长可以对“生物盾计划”获得的所有医疗应对措施发布“紧急使用授权”,并能修改执行中的“紧急使用授权”。当卫生和公众服务部长确定潜在紧急情况不再存在时,所有“紧急使用授权”即刻到期。在紧急情况期间,即使没有获得“紧急使用授权”,在没有单独处方的情况下,仍然可以大量分配经批准的医疗应对措施。联邦、州或地方政府还被允许在紧急情况下预先准备或储备未经批准的医疗应对措施。
(3)部门间协作
对于储备CBRN毒剂医疗应对措施的战略执行,公共卫生紧急医疗应对措施事务机构负责协调几个联邦部门的活动,以确保相关需求得到有效满足。公共卫生紧急医疗应对措施事务机构由卫生与公众服务部负责预防和应对的助理部长领导,其成员包括来自食品药品监督管理局、疾病控制和预防中心、国家卫生研究院、国防部、国土安全部、农业部和退伍军人事务部的代表。公共卫生紧急医疗应对措施事务机构从产品的角度,协调联邦政府的工作,以加强防范CBRN毒剂与新出现传染病,并通过机构内与机构间协作,致力于支持和鼓励开发、采购和储备医疗应对措施产品。
(4)项目的完善
自2004年《生物盾计划法》通过以来,国会采取进一步措施来完善“生物盾计划”。2006年《大流行病和所有危险防范法》在卫生与公众服务部中设立了生物医学高级研究和开发局以及预防和应对助理部长职位,并修改了“生物盾计划”的采购程序。其中生物医学高级研究和开发局负责监督卫生与公众服务部所有的“生物盾计划”采购。生物医学高级研究和开发局有两个独立的机制来支持CBRN毒剂医疗应对措施高级开发和商业化:医疗应对措施高级开发合同和具有“开发‘里程碑付款’”的“生物盾计划”收购合同,生物医学高级研究和开发局通常使用这两种合同来开发和商业化潜在的、可被“生物盾计划”收购的医疗应对措施。理论上,卫生与公众服务部可以通过国家卫生研究院支持的基础研究以及由生物医学高级研究和开发局支持的高级开发和商业化来加速相关医疗应对措施开发。卫生与公众服务部可以通过生物医学高级研究和开发局使用“生物盾计划”基金或通过疾病控制和预防中心动用国家战略储备基金购买医疗应对措施。
2013年《再授权法》明确允许“生物盾计划”医疗应对措施采购合同包括开发成本。此外,它允许“生物盾计划”合同可以在医疗应对措施预期交付日期前10年签订,而不是之前法律规定的8年。《再授权法》还要求卫生与公众服务部负责预防和应对的助理部长为医疗应对措施的基础和高级研究、开发和采购活动制定年度“5年调整预算计划”,并编制和每年更新“公共卫生紧急医疗应对措施事务机构战略和实施计划”,并将其提交给国会。2019年《准备法》为生物医学高级研究和开发局在2019至2023财年期间预拨款61.17亿美元,以支持医疗应对措施的高级开发。
卫生与公众服务部授予“生物盾计划”12项针对炭疽热、天花、肉毒毒素、放射性和核以及神经毒剂CBRN威胁的医疗应对措施合同,这些对策包括疫苗、抗体、抗病毒药物和化合物。
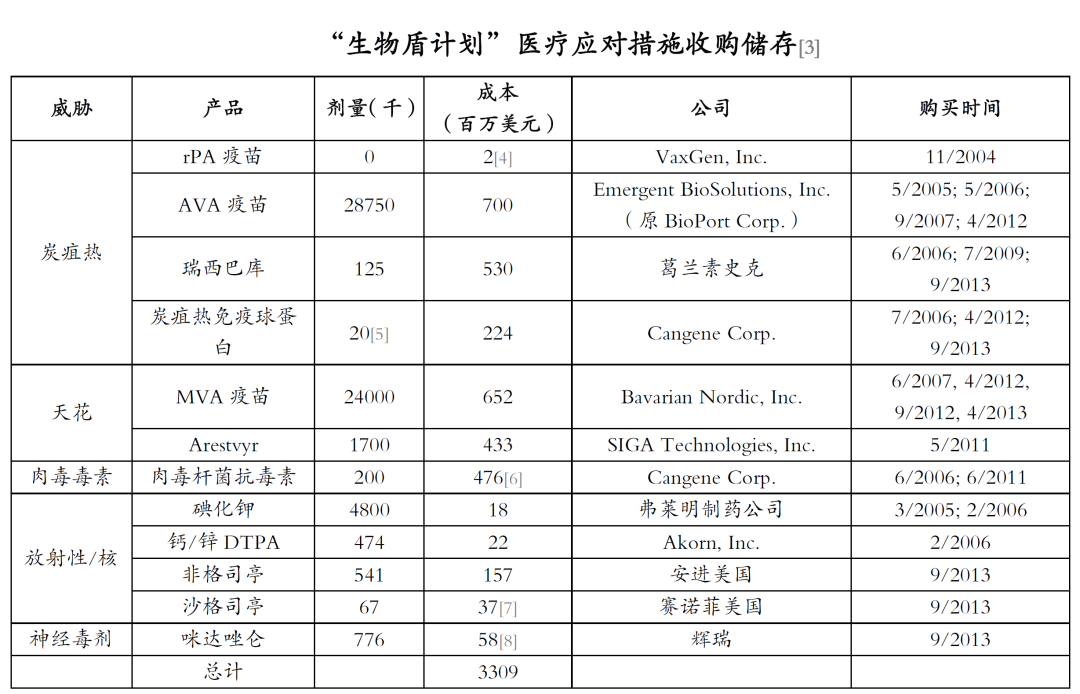
此外,卫生与公众服务部可以使用“生物盾计划”来获取那些缺乏食品药品监督管理局批准进入“国家战略储备”的产品。炭疽免疫球蛋白、瑞西巴库、MVA天花疫苗、Arestvyr和肉毒杆菌抗毒素在卫生与公众服务部购买时没有得到食品药品监督管理局的批准。“生物盾计划”合同要求医疗应对措施开发商就其产品的预期库存用途寻求食品药品监督管理局批准。在紧急情况下,缺乏食品药品监督管理局批准的医疗应对措施可根据“紧急使用授权”进行分配。
2003年的“非典”和2020年的新冠肺炎疫情反映出我国正面临巨大而现实的生物安全挑战,暴露了我国防范大规模新发急性传染病的弱点。因此加快制定我国国家生物安全与生物防御战略,是保护人民生命健康、保障民族核心利益、维护社会稳定和国家安全的必然要求。参考美国生物防御体系建设的经验,结合我国的实战经验教训,现就完善我国生物安全战略以及生物防御体系提出以下几点建议:

2014年4月15日,习近平总书记在中央国家安全委员会第一次全体会议上提出了总体国家安全观重大战略思想,为新形势下维护国家安全工作确立了重要遵循。疫情发生后,习近平总书记多次谈到国家生物安全的理念,强调重大传染病和生物安全风险是事关国家安全和发展、事关社会大局稳定的重大风险挑战,必须把生物安全纳入国家安全体系。因此,我国应加强国家生物安全战略的顶层设计,制定和实施《国家生物安全战略》和《国家生物安全行动计划》,把生物安全明确地纳入国家安全体系,全面深入研究我国生物安全环境、形势以及面临的威胁挑战,制定国家层面的战略性文件来系统性地规划国家生物防御体系,明确各部门的职责权限,加强危机处置时的跨部门协调,提升国家生物安全治理的能力和水平。
建设中国特色社会主义法治体系,必须坚持立法先行,发挥立法的引领和推动作用。生物安全立法显然是其中的重要内容之一。我国需尽快颁布《国家生物安全法》,并配合《中华人民共和国刑法》《突发公共卫生事件应急条例》《国家突发公共卫生事件应急预案》《国家突发公共事件医疗卫生救援应急预案》和《突发公共卫生事件与传染病疫情监测信息报告管理办法》等相关法律法规的修订完善,加快构建国家生物安全法律法规体系、制度保障体系。通过修订和完善生物安全法律体系,用法律武器来主动防范生物安全威胁,有效保护人民健康,保障国家生物安全,维护国家长治久安。
我国急需建立从中央到地方各级政府的多部门工作协调机制,完善国家生物安全治理体系和规范化管理运行机制,切实提升国家生物安全治理和风险防范能力。在中央层级,中央国家安全委员会可新建一个由国家安全部、中国疾控中心、国家卫生健康委、国家药品监督管理局、农业农村部等部委参与的国家应对生物危机委员会。这样的设置将有利于中央在应对重大生物安全事件时及时获取信息并有效推进跨部门协作。同时,对中国疾控中心的职能权力进行改革。中国疾控中心应该从国家卫生健康委下属事业单位提升为拥有公共卫生决策实权的国家职能部门。此次疫情暴发凸显了建立应对生物威胁的国家医疗战略储备制度和应急供应机制的重要性。应该尽快梳理可能会对我国造成重大威胁的生物安全风险,加强生物安全领域基础研究,为国家生物安全战略提供关键科学支撑。加强我国传统医药和现代医药的创新研发,推动与生物安全相关的针对性疫苗、疗法和特效药的长期研发和战略预防。我国人口众多,一旦暴发生物安全事件,医疗物资的储备与供应将面临巨大挑战。因此,建立应对生物威胁的国家医疗战略储备制度和应急供应机制,居安思危,未雨绸缪,对于提高我国应对重大生物安全事件的应急管理效率和水平具有重大意义。
注释: